Resumen ejecutivo
En el presente trabajo se comenta brevemente la historia del cannabis, con especial interés en sus efectos medicinales, conocidos al menos desde 4.000 a.C. pero cuya investigación científica adecuada y aplicación con fines terapéuticos fueron postergados largo tiempo.
La epilepsia resistente a la medicación antiepiléptica convencional representa un área con importantes necesidades insatisfechas. Las encefalopatías epilépticas del desarrollo, como los síndromes de Dravet y Lennox-Gastaut, caracterizados por crisis farmacorresistentes y severo déficit neurocognitivo, son ejemplo de las profundas consecuencias de estas enfermedades para los pacientes y sus familiares/cuidadores.
Se describen los ensayos clínicos del programa de desarrollo de Cannabidiol de calidad farmacéutica, derivado de la planta Cannabis sativa L y altamente purificado, para tratar la epilepsia resistente. Los sólidos datos de estos estudios resultaron en la aprobación del fármaco para el tratamiento de los síndromes de Dravet y de Lennox-Gastaut en pacientes mayores de 2 años de edad, por parte de la Food and Drug Administration (FDA) en Estados Unidos en 2018, y de la European Medicines Agency (EMA) en la Unión Europea en 2019 (en combinación con clobazam). Actualmente, la FDA aprobó el uso de Cannabidiol para el tratamiento del complejo de esclerosis tuberosa y expandió su indicación a pacientes mayores de 1 año.
Para contribuir a la práctica clínica, se brindan detalles de la prescripción, posología, interacciones medicamentosas y recomendaciones para la administración de Cannabidiol.
Por último, se propone conocer el espectro de investigaciones científicas en curso en las cuales se explora el potencial del Cannabidiol en enfermedades neurodegenerativas, psiquiátricas y otras.
Introducción a la historia del cannabis
La planta de cannabis pertenece a la familia de las Cannabináceas. Se han clasificado tres especies (Cannabis sativa, Cannabis indica y Cannabis rudelaris) aunque actualmente se afirma que existe una única especie heterogénea: C. sativa L. (Russo s.f.).
El cannabis es originario de Asia Central y Oriental: datos de paleobotánica indican su presencia hace más de 11.000 años (Russo s.f.). El cáñamo, como también se conoce a la planta de C. sativa usada con fines industriales,
es fuente de fibras textiles y de alimento, y sus semillas han proporcionado aceites y nutrientes (son ricas en proteínas y ácidos grasos esenciales linoleico y linolénico) (Crocq 2020). Siguiendo la migración de poblaciones
nómades, así como las prácticas de agricultura y comercio, su cultivo y uso se extendieron en el curso de los siglos hacia Europa Central, África y finalmente, al continente americano, donde fue traído por los colonizadores
europeos (Russo s.f., Crocq 2020).
Con respecto al uso medicinal del cannabis, la primera prueba documentada se encuentra en China y data de 4.000 años a.C. (Russo s.f., Crocq 2020). En el antiguo Egipto, papiros y tejidos dan cuenta del empleo tópico de cannabis
aproximadamente 1.500 años a.C. (Russo s.f., Crocq 2020). En Medicina Ayurvédica, el cannabis ha sido utilizado durante miles de años para disminuir el dolor, las náuseas y la ansiedad, para mejorar el apetito y el sueño,
relajar los músculos y generar un sentimiento de euforia.
Heródoto y Galeno mencionaron los efectos psicoactivos de las semillas; Plinio el Viejo y Dioscórides también describieron diversas aplicaciones medicinales del cannabis. En el siglo XIX, dos médicos europeos, William O’Shaughnessy
y Jacques-Joseph Moreau de Tours, documentaron el uso de cannabis durante su permanencia en India y Oriente Medio (Russo s.f., Crocq 2020).
En Occidente, el cannabis se difundió extensamente entre los siglos XIX y XX. La Reina Victoria de Inglaterra lo utilizaba para controlar la dismenorrea y la Emperatriz Elisabeth (Sissi) de Austria, para la tos (Crocq 2020). Tanto en Europa como en América, el consumo de cannabis y sus extractos tuvo amplia difusión con fines recreativos así como medicinales, redescubriéndose indicaciones como la migraña, el dolor neuropático y las artromialgias (Russo s.f.). Los efectos psicoactivos fueron aprovechados en ambientes artísticos, especialmente literario y musical (Russo s.f., Crocq 2020).
A lo largo de la historia, han alternado períodos de tolerancia con otros de represión del consumo de cannabis (Russo s.f.). Algunos de los principales problemas con el uso medicinal se debieron a que no había sido posible aún identificar y separar el ingrediente con efecto psicoactivo (tetrahidocannabinol [THC]) de aquellos con beneficios para la salud (Cannabidiol [CBD]), la heterogeneidad en los métodos de extracción y preparación de los productos medicinales, y el uso de plantas cultivadas en diferentes regiones y condiciones y, por lo tanto, con distinto contenido de agentes terapéuticos (Russo s.f.; Golub 2021).
En el siglo XX, una serie de prohibiciones legislativas condujeron a su retiro de las farmacias en todo el mundo, a pesar de la recomendación por parte de médicos y diversas comisiones evaluadoras (Russo s.f.; Crocq 2020). En 1961, la Convención Única sobre Estupefacientes de la Organización de Naciones Unidas (ONU) incluyó al cannabis en la Lista IV (con propiedades particularmente peligrosas y escaso o nulo valor terapéutico), junto con la heroína. A partir de 1970-71, tanto en Estados Unidos como en Reino Unido, las leyes cada vez más estrictas y las penas legales hicieron prácticamente imposible la investigación médica y el empleo terapéutico del cannabis (Russo s.f.; Crocq 2020).
Hacia 1940, el CBD fue aislado por primera vez, pero no fue hasta 1963 que Mechoulam y col. elucidaron su estructura (Golub 2021). Esto posibilitó que, un año después, el principal fitocannabinoide psicoactivo, el THC, fuera
aislado y sintetizado también por Mechoulam y col. Sus hallazgos impulsaron el descubrimiento del sistema endocannabinoide (SEC), un nuevo sistema con importantes funciones en la salud y la enfermedad (Crocq 2020; Golub
2021).
La identificación del compuesto psicoactivo y el conocimiento del SEC iniciaron una nueva era en la historia del cannabis (Crocq 2020; VanDolah 2019). Comprender que los efectos cannabinoides son parte de nuestra fisiología,
especialmente en el sistema nervioso central (SNC), tornó esencial continuar la investigación. En los últimos años, se ha revalorado el potencial terapéutico de los medicamentos derivados del cannabis en enfermedades con
necesidades terapéuticas insatisfechas, tales como esclerosis múltiple, epilepsia, cáncer, SIDA y otras (Russo; Raucci 2020). El creciente interés público y científico en el potencial terapéutico de los productos derivados
del cannabis se refleja en los recientes cambios en la legislación (Raucci 2020).
El 2 de diciembre de 2020, la Comisión de Estupefacientes (CND) de la ONU aprobó la propuesta de la Organización Mundial de la Salud de retirar el cannabis y la resina de cannabis de la Lista IV de la Convención Única de Estupefacientes
de 1961 y mantenerlos sujetos a los niveles de control de la Lista I (como la morfina). Dicha lista incluye sustancias particularmente susceptibles de uso indebido y de producir efectos nocivos, y que pueden incluirse en
la Lista IV si tal susceptibilidad no fuera compensada por ventajas terapéuticas. Esta medida histórica reconoció las propiedades medicinales del cannabis, al cual puede accederse bajo supervisión profesional (CND Press
reléase 2020). En la Unión Europea, el CBD es una sustancia no controlada y los productos para uso medicinal se aprueban si no contienen más de 0,2% de THC (Raucci 2020).
Clasificación de los cannabinoides y sistema endocannabinoide
Con el término cannabinoide se hace referencia a todos los compuestos que interactúan con proteínas receptoras específicas del sistema endocannabinoide (Cather 2020). Se distinguen tres tipos de cannabinoides (Crocq 2020; Golub
2021; Cather 2020; VanDolah 2019; Silvestro 2019):

El SEC constituye un sistema de señalización cerebral complejo y extenso. Está constituido por (Crocq 2020; Golub 2021; Cather 2020; Almeida 2020; Basavarajappa 2017; Farrelly 2021):
- Endocannabinoides:
- Araquidonil-etanolamida (AEA).
- 2-araquidonilglicerol (2-AG).
- Compuestos similares a la anandamida.
- Endocannabinoides:
- Araquidonil-etanolamida (AEA).
- 2-araquidonilglicerol (2-AG).
- Compuestos similares a la anandamida.
- Vías de síntesis, recaptación y degradación enzimática.
- Hidrolasa de amidas de ácido graso (FAAH, en inglés) para la degradación de AEA.
- Lipasa de monoacil glicerol (MAGL, en inglés) para la degradación de 2-AG.
- Receptores cannabinoides (CB) de membrana, acoplados a proteína G:

El SEC se distingue por su señalización retrógrada (Figura 1): AEA y 2-AG son producidos en la neurona postsináptica a demanda (no se almacenan) después de la activación neuronal → son liberados al espacio sináptico → actúan sobre el terminal presináptico en sentido retrógrado → activan receptores CB1 presinápticos → conducen a disminución de la liberación de neurotransmisor por la neurona presináptica (Crocq 2020; Cather 2020; Almeida 2020; Basavarajappa 2017; Farrelly 2021).
Esta señalización retrógrada constituye un mecanismo de retroalimentación inhibitoria para regular la liberación de neurotransmisores en el cerebro (Basavarajappa 2017; Farrelly 2021). Tal mecanismo se ha asociado con la inhibición a largo plazo de neuronas glutamatérgicas estimulatorias y GABAérgicas inhibitorias, y con el control de la plasticidad neuronal a corto y a largo plazo (Almeida 2020). Desde el punto de vista terapéutico, su modulación plantea la posibilidad de modificar la actividad neuronal aberrante como en diversas enfermedades neurodegenerativas, o paroxística como en la epilepsia (Farrelly 2021).

Vías de señalización y actividad de los cannabinoides
A través de un amplio rango de vías de señalización, que aún no se conocen completamente, los endocannabinoides regulan múltiples procesos neurofisiológicos: estado de ánimo, apetito y regulación de la energía, aprendizaje
y memoria, dolor e inflamación, y sueño (Golub 2021; Cather 2020; Almeida 2020). Los cannabinoides, en particular el CBD, pueden actuar también sobre otros sistemas de receptores, además de los propios. Tienen capacidad
para (Golub 2021; Cather 2020; Almeida 2020):
- modular canales iónicos (Na+, K+, Ca++),
- modular proteínas transportadoras de membrana,
- activar receptores de potencial transitorio vaniloides (TRPV) tipo 1 y 2, activar receptores serotoninérgicos 5-HT1A,
- modular alostéricamente receptores μ y δ opioides,
- unirse a otros receptores acoplados a proteína G como GPR55,
- interactuar con receptores nucleares activados por el proliferador de peroxisomas gamma (PPARγ),
- inhibir la recaptación de adenosina.
El THC es agonista parcial de los receptores CB1 y CB2, a los que se une con alta afinidad, y puede actuar sobre diferentes receptores no cannabinoides. Entre sus efectos farmacológicos se incluyen: efecto orexígeno, inhibición de náuseas/vómitos, inhibición del dolor y la espasticidad. También se han demostrado efecto antioxidante, neuroprotector, antiinflamatorio y antitumoral, según evidencia preclínica. Es el principal responsable de los efectos psicoactivos y el potencial de adicción (Golub 2021; Almeida 2020).
El CBD muestra baja afinidad de unión con los receptores CB1 y CB2, sobre los que muestra acción antagonista. Por otro lado, inhibe la enzima responsable de la recaptación e hidrólisis de anadamida (aumentando
la disponibilidad del endocannabinoide). Actúa como antagonista del receptor GPR55 acoplado a proteína G y es agonista del PPARγ. Posee efectos clínicos anticonvulsivante, ansiolítico, antipsicótico y antidepresivo, y evidencia
preclínica demuestra que posee propiedades antioxidantes, antiinflamatorias, antitumorales y neuroprotectoras (Golub 2021; Almeida 2020; Silvestro 2019).
Además, el CBD muestra actividad agonista serotoninérgica 5-HT1A (efecto ansiolítico y antidepresivo), activación de receptores vaniloides TRPV1 y TRPV2 (analgesia y efecto antiinflamatorio) y efecto agonista parcial de los receptores dopaminérgicos D2 (Golub 2021; Almeida 2020; VanDolah 2019).
Se ha informado que el CBD contrarresta algunos efectos psicoactivos del THC y mejora su tolerabilidad (Golub 2021). Reduce la ansiedad y los efectos símil psicosis, y atenúa la alteración en los procesos emocionales y de recompensa
posteriores a la administración de THC (Almeida 2020). Estos efectos a nivel del SNC podrían relacionarse con la regulación alostérica negativa de los receptores CB1 (Almeida 2020).
Epilepsia resistente: Síndrome de Lennox-Gastaut, Síndrome de Dravet y Complejo esclerosis tuberosa
En la población general, la epilepsia constituye una de las enfermedades neurológicas más frecuentes, con prevalencia de 0,5-1%, y la frecuencia es mayor en los países de ingresos bajos o medianos (Von Wrede 2021; Zaheer 2018).
La epilepsia se define clínicamente como un síndrome de crisis epilépticas recurrentes no provocadas, o una crisis con evidencia de riesgo > 60% de recurrencia dentro de los siguientes 10 años (Von Wrede 2021).
La crisis epiléptica es un fenómeno paroxístico transitorio, fisiopatológicamente relacionado con actividad hipersincrónica anormal en el cerebro (Silvestro 2019). Las descargas epileptogénicas son resultado de hiperexcitabilidad neuronal causada por alteraciones en canales iónicos dependientes de voltaje y en los niveles de neurotransmisores.
El objetivo del tratamiento con fármacos antiepilépticos (FAE) es controlar las crisis reduciendo la excitabilidad neuronal, a través del bloqueo de la acción de neurotransmisores excitatorios como el glutamato, o de la estimulación
de neurotransmisores inhibitorios como el ácido gamma aminobutírico (GABA) (Silvestro 2019). Los mecanismos de acción más conocidos involucran la modulación de canales de sodio (Na+) y calcio (Ca++) dependientes de voltaje,
responsables del potencial de acción y del control de la excitabilidad neuronal (Silvestro 2019).
Aproximadamente un 30% de los pacientes con epilepsia continúan presentando crisis a pesar del desarrollo de nuevos FAE. De acuerdo con la definición de la International League Against Epilepsy (ILAE), estos pacientes se consideran resistentes o refractarios al tratamiento cuando no logran estar libres de crisis pese al empleo de al menos dos FAE, en monoterapia o combinados, adecuadamente seleccionados y bien tolerados (Von Wrede 2021; Villanueva 2021; Golub 2021; Silva 2020; Farrelly 2021).
Entre las causas de epilepsia resistente al tratamiento se encuentran las encefalopatías epilépticas del desarrollo (EED), un grupo heterogéneo de síndromes epilépticos de inicio temprano en la infancia, genéticamente determinadas,
con pobre pronóstico hasta el presente. Las EED se caracterizan por presentar crisis con resistencia farmacológica grave, electroencefalograma profundamente alterado, deterioro neurocognitivo, retraso del desarrollo, fenotipo
variable y resonancia magnética cerebral usualmente anormal. El Síndrome de Lennox-Gastaut y el Síndrome de Dravet se consideran dos de las EED más graves de la infancia (Villanueva 2021).
La calidad de vida de los pacientes con EED y sus familiares/cuidadores habitualmente es pobre. A la carga de la enfermedad se suma la frecuente presencia de comorbilidades, los problemas de tolerancia y efectos secundarios
de los FAE, y el impacto de la discapacidad cognitiva, psicosocial y conductual (Strzelczyk 2020; ANMAT 2017). Estos pacientes presentan riesgo aumentado de muerte súbita inexplicada en la epilepsia (SUDEP) y otras formas
de mortalidad relacionadas con la epilepsia. Además, a menudo se requiere tratamiento invasivo, ya sea cirugía para la epilepsia o neuroestimulación, lo cual aumenta la morbilidad y la carga para el sistema de salud y la
familia (ANMAT 2017; Strzelczyk 2020; Strzelczyk 2021; Villanueva 2021).
El diagnóstico temprano de los Síndromes de Lennox-Gastaut y de Dravet es fundamental para iniciar el tratamiento lo antes posible y limitar el desarrollo y la progresión de la enfermedad (Villanueva 2021; Strzelczyk 2020;
Strzelczyk 2021).
Síndrome de Lennox-Gastaut
(Strzelczyk 2021; Villanueva 2021; Golub 2021)
- El Síndrome de Lennox-Gastaut (SLG) es una EED, de inicio en la infancia y cambiante a lo largo de la vida. Puede presentarse junto a una variedad de etiologías, siempre con uno de sus rasgos distintivos: la epilepsia resistente
al tratamiento.
- El SLG es infrecuente: la tasa de incidencia es 2 casos por cada 100.000 niños y representa 2-5% de todas las epilepsias infantiles. La edad de inicio es antes de los 12 años, con pico de presentación entre los 3 y los
5 años de edad.
- No existe una definición uniforme del SLG, pero se ha establecido una tríada de características electroclínicas:
- Múltiples tipos de crisis epilépticas farmacorresistentes,
- Patrones electroencefalográficos anormales, típicamente con descargas generalizadas de punta-onda lenta, y
- Trastorno cognitivo grave.
- Las crisis epilépticas distintivas son las tónicas generalizadas y las ausencias atípicas; pero puede haber crisis clónicas, mioclónicas o tónico-clónicas generalizadas. Un tipo particular de crisis, las crisis de caída
(
drop attacks), generan muy alta morbilidad y gran preocupación en los padres, debido a que la súbita pérdida generalizada del tono muscular o una crisis tónica originan caídas al suelo y lesiones que pueden
ser graves. Están presentes en un 50% de los casos.
- En el interictal en vigilia, el hallazgo característico es el patrón de punta-onda lenta periódica a < 3 Hz, generalizado, que puede evolucionar a patrones ictales subclínicos. Los pacientes pueden presentar estado epiléptico no convulsivo. Durante el sueño pueden detectarse ritmos rápidos paroxísticos.
- Los niños con SLG presentan retraso del desarrollo, discapacidad cognitiva y trastornos de conducta que pueden incluir hiperactividad, agresión y comportamiento autista.
- El diagnóstico temprano del SLG es fundamental, pero existen múltiples dificultades para lograrlo:
- Es un síndrome con múltiples manifestaciones clínicas, que evolucionan en el tiempo,
- La tríada de rasgos característicos no siempre está presente de inicio,
- No se dispone de ningún marcador biológico específico,
- El diagnóstico diferencial puede ser difícil con otras encefalopatías epilépticas,
- La etiología es múltiple y variada.
- Es un síndrome con múltiples manifestaciones clínicas, que evolucionan en el tiempo,
- Las etiologías conocidas involucran daño estructural, metabólico o genético:
- Accidente cerebrovascular,
- Malformación del desarrollo (displasia cortical),
- Infecciones congénitas del sistema nervioso central,
- Tumor cerebral,
- Puede derivar de otra encefalopatía de inicio temprano (síndrome de West u Ohtahara),
- Otros trastornos genéticos (complejo de esclerosis tuberosa, metabolopatías), etc.
- Hasta un 33% de los casos son de causa desconocida (posible mutación genética de novo). Al presente, se han identificado alteraciones en los siguientes genes asociados con SLG: ALG13; CDH2; DCX; DNAJC6; DNM1; FASN; FLNA; GABBR2; GABRB3; GRIN2B; HNRNPH1; HNRNPU; IQSEC1; IQSEC2; MTOR; RANGAP1; RYR3; SCN8A; SLC35A2; STXBP1.
- El tratamiento del SLG es otro gran desafío: por una parte, las crisis resistentes a los FAE convencionales plantean la búsqueda continua de opciones eficaces, previo a las alternativas invasivas; por otro lado, debido a que no existe una etiología única y la enfermedad es cambiante con el tiempo, el tratamiento debe ser siempre individualizado.
- Dentro de la farmacoterapia, el valproato continúa siendo la terapia de preferencia en primera línea, generalmente en combinación con lamotrigina o clobazam. Otros FAE aprobados como terapia adyuvante son rufinamida, topiramato, zonisamida y felbamato, y recientemente, Cannabidiol.
- Las opciones terapéuticas no farmacológicas incluyen: dieta cetogénica, estimulación del nervio vago, cirugía resectiva para la epilepsia y callosotomía.
Síndrome de Dravet
(Strzelczyk 2020; Villanueva 2021; Golub 2021)
- El Síndrome de Dravet (SD) es otra EED, de origen genético, conocida anteriormente como epilepsia mioclónica severa de la infancia. Como el SLG, se caracteriza por crisis epilépticas resistentes al tratamiento, trastornos
del control motor (ataxia, disartria, parkinsonismo, etc.) y de la conducta, y deterioro cognitivo.
- El SD es un trastorno infrecuente: la tasa de incidencia es 1 caso por cada 15.000-33.000 recién nacidos vivos. Comienza durante el primer año de vida (media: 5-8 meses), en un niño con desarrollo normal hasta ese momento.
- Se han caracterizado tres etapas clínicas progresivas:
- Etapa febril, con crisis febriles complejas prolongadas y estado epiléptico.
- Etapa de agravamiento, entre las edades de 1 y 5 años, con aparición de otros tipos de crisis epilépticas (motoras generalizadas, atípicas, mioclónicas y ausencias) y déficit psicomotor.
- Etapa progresiva no epiléptica, desde los 5 años en adelante, con reducción de las crisis epilépticas y profundización del deterioro neurocognitivo, lo que genera altos niveles de dependencia.
- Los pacientes con SD afrontan alto riesgo de mortalidad (15%) debido a SUDEP. El estado epiléptico y los accidentes contribuyen a elevadas tasa de internaciones y morbimortalidad.
- El 80% de los casos se vinculan con mutaciones en el gen SCN1A, que codifica la subunidad α-1 de los canales de sodio dependientes de voltaje neuronales. Otras alteraciones se han localizado en los siguientes genes:
CDH2; GABRA1; GABRG2; HCN1; PCDH19; SCN1A; SCN1B; SCN2A; SCN9A; STXBP1.
- El diagnóstico de SD se dificulta por su similitud con otras epilepsias resistentes, y la realización de pruebas genéticas está mejorando su diagnóstico más temprano.
- Los pacientes con SD rara vez logran hallarse libres de crisis con los FAE convencionales, de modo que el objetivo del tratamiento suele ser reducir la frecuencia de las crisis y minimizar los efectos adversos de la medicación.
En general, valproato y clobazam son los fármacos de primera elección; estiripentol, fenfluramida, topiramato y Cannabidiol son nuevas opciones que han mostrado eficacia como terapia adyuvante en segunda línea. En tercera
línea, pueden emplearse clonazepam, levetiracetam y zonisamida.
- Los FAE que bloquean los canales de sodio se encuentran contraindicados debido a que empeoran las crisis epilépticas. La dieta cetogénica y la estimulación del nervio vago pueden contribuir al tratamiento. Otras medidas incluyen minimizar los estímulos desencadenantes conocidos de las crisis.
Complejo esclerosis tuberosa
(Curatolo 2015; Aronica 2023; Peron 2018; Northrup H 2013; Goodrick S. 2015; Northrup 199; Lyczkowski 2007; Schwartz RA 2007; Yates JR 2011; Joinson C, 2003; Farach LS 2020)
- El Complejo de Esclerosis Tuberosa (CET) es un trastorno genético, autosómico dominante y multisistémico con expresión variable que afecta diversos órganos, incluyendo cerebro, ojos, riñón, corazón, pulmones, hígado y piel. Es causado principalmente por mutaciones en uno de los genes supresores de tumores TSC1(9q34.3) o TSC2(16p13.3). (Curatolo 2015)
- Las mutaciones en estos genes interrumpen el complejo proteico intracelular TSC1-TSC2, resultando en la sobreactivación del complejo proteico de la diana de rapamicina en mamíferos (mTOR). El mTOR es esencial para el desarrollo cortical humano, regulando la supervivencia y proliferación de células madre neurales, migración neuronal, y formación de axones y dendritas. (Aronica 2023)
- La incidencia del CET es de 1 entre 6.000 a 1 entre 10.000 nacidos vivos, sin diferencias por sexo, raza o etnia. (Peron 2018). El sistema nervioso central se ve afectado en más del 90% de los pacientes, presentando lesiones como tubérculos corticales, nódulos subependimarios, astrocitomas de células gigantes y líneas de migración de sustancia blanca. (Northrup H 2013, Curatolo 2015)
- La mayoría de los pacientes presenta lesiones cutáneas características. La tríada diagnóstica clásica (convulsiones, discapacidad intelectual y angiofibromas faciales) se encuentra en menos de un tercio de los casos. (Goodrick S. 2015, Northrup 1993, Lyczkowski 2007, Schwartz RA 2007).
- Las convulsiones son la manifestación inicial más común, afectando al 79-90% de los pacientes. Aproximadamente el 60% de los casos experimenta convulsiones durante el primer año de vida, pero el riesgo persiste en la vida adulta. Los factores de riesgo incluyen hamartomas glioneuronales corticales y variantes patogénicas del gen TSC2. El EEG muestra anormalidades en el 75% de los pacientes. (Yates JR 2011, Joinson C, 2003, Farach LS 2020).
- El abordaje integral y la comprensión de la base genética son cruciales para el diagnóstico y manejo de esta compleja enfermedad.
Cannabidiol: nuevo paradigma en el tratamiento de las EED
Los FAE de nueva generación no han logrado mejorar significativamente la tasa de pacientes con EED libres de crisis. Los pacientes se encuentran habitualmente sometidos a politerapia asociada con eficacia limitada y efectos adversos relevantes. Por lo tanto, la búsqueda de nuevas terapias efectivas es una necesidad para esta población de pacientes (Von Wrede 2021; Villanueva 2021; Golub 2021).
A fines del siglo XIX, renombrados neurólogos británicos informaron la reducción de la frecuencia de las crisis en pacientes epilépticos que utilizaron cannabis. No obstante, solo a partir de la década de 1970 se retomaron
los estudios en este campo (Golub 2021; Zaheer 2018). Hasta 2016, la eficacia y la seguridad del cannabis y Cannabidiol (CBD) para tratar la epilepsia resistente había sido explorado en estudios de pequeño tamaño y baja
calidad metodológica, que usaron preparaciones heterogéneas, con resultados alentadores pero inconcluyentes (Von Wrede 2021; Zaheer 2018; Silva 2020; Raucci 2020).
La difusión en los medios de comunicación y las redes sociales de la experiencia positiva de diferentes familias que observaron la notable reducción de la frecuencia de las crisis (desde 50% hasta 100%) en casos de epilepsia
resistente, con el uso de cannabis u otros productos enriquecidos en CBD, generó mayor presión social y contribuyó a impulsar la investigación científica en los últimos años (Von Wrede 2021; Golub 2021; Raucci 2020).
Cannabidiol es una molécula que se obtiene de la planta Cannabis sativa L. Carece de propiedades psicoactivas, no produce el efecto euforizante asociado con el cannabis, y su capacidad de inducir abuso es mínima. Es
el primer fármaco de una nueva clase de medicamentos anticrisis para tratar la epilepsia (Villanueva 2021).
Se conoce que las propiedades anticonvulsivantes del Cannabidiol no se relacionan con su acción directa sobre los receptores cannabinoides (Villanueva 2021; Basavarajappa 2017).
Aunque no se ha establecido con exactitud el mecanismo de acción antiepiléptica del Cannabidiol, se plantean múltiples mecanismos potenciales con reducción de la hiperexcitabilidad neuronal, que constituye la fisiopatología de base de la epilepsia. La modulación intracelular del Ca++ por los receptores GPR55 y TRPV1, así como la modulación de vías de señalización mediadas por adenosina mediante la inhibición de la recaptación de adenosina (bloqueo del transportador equilibrador de nucleósidos 1 [ENT-1]), parecen desempeñar un papel importante (Von Wrede 2021; Strzelczyk 2020; Villanueva 2021; Golub 2021; Raucci; Farrelly 2021).
Por otra parte, Cannabidiol es un compuesto pleiotrótipo, con propiedades antioxidantes, reduce citocinas proinflamatorias, promueve la neurogénesis y atenúa la neurodegeneración, propiedades que pueden contribuir a modificar los procesos fisiopatológicos de base y los déficits neurodegenerativos presentes en la epilepsia (Farrelly 2021; Golub 2021).
En 2016, Devinsky y col. presentaron un estudio de tratamiento abierto con 214 pacientes (edad: 1 a 30 años) con epilepsia resistente de inicio en la infancia y diversa etiología, incluyendo SLG y SD. Durante 12 semanas, los pacientes recibieron una formulación de Cannabidiol de calidad farmacéutica (100 mg/mL), en dosis inicial de 5 mg/kg/día incrementada hasta un máximo de 25-50 mg/kg/día según tolerancia, junto con los FAE habituales (Silva 2020; Von Wrede 2021; Farrelly 2021). En conjunto, las crisis mensuales se redujeron con una mediana de 35%, que alcanzó el 54% para las crisis atónicas. Los pacientes con SD mostraron la tasa más alta de reducción de las crisis motoras (50%) (Von Wrede 2021; Farrelly 2021).
Posteriormente, se realizaron ensayos clínicos pivotales de fase 3, aleatorizados, a doble ciego, controlados con placebo y de grupos paralelos, demostraron la eficacia y la seguridad de la misma formulación de Cannabidiol de calidad
farmacéutica, purificado, en el tratamiento del SD y del SLG (Strzelczyk 2020; Strzelczyk 2021; Von Wrede 2021; Villanueva 2021; Golub 2021; Thiele 2021).
La evidencia científica condujo a la aprobación del Cannabidiol para el tratamiento de los síndromes de Dravet y de Lennox-Gastaut en pacientes mayores de 2 años de edad, por parte de la Food and Drug Administration (FDA) en Estados Unidos en 2018, y de la European Medicines Agency (EMA) en la Unión Europea en 2019 (en combinación con clobazam). Recientemente, la FDA aprobó el uso de Cannabidiol para el tratamiento del complejo
de esclerosis tuberosa y expandió su indicación a pacientes mayores de 1 año.
Programa de desarrollo de Cannabidiol en epilepsia resistente
El programa de desarrollo clínico de Cannabidiol incluyó ensayos clínicos de fase 3, multicéntricos, aleatorizados, a doble ciego, controlados con placebo, y con grupos paralelos (Tabla 1):
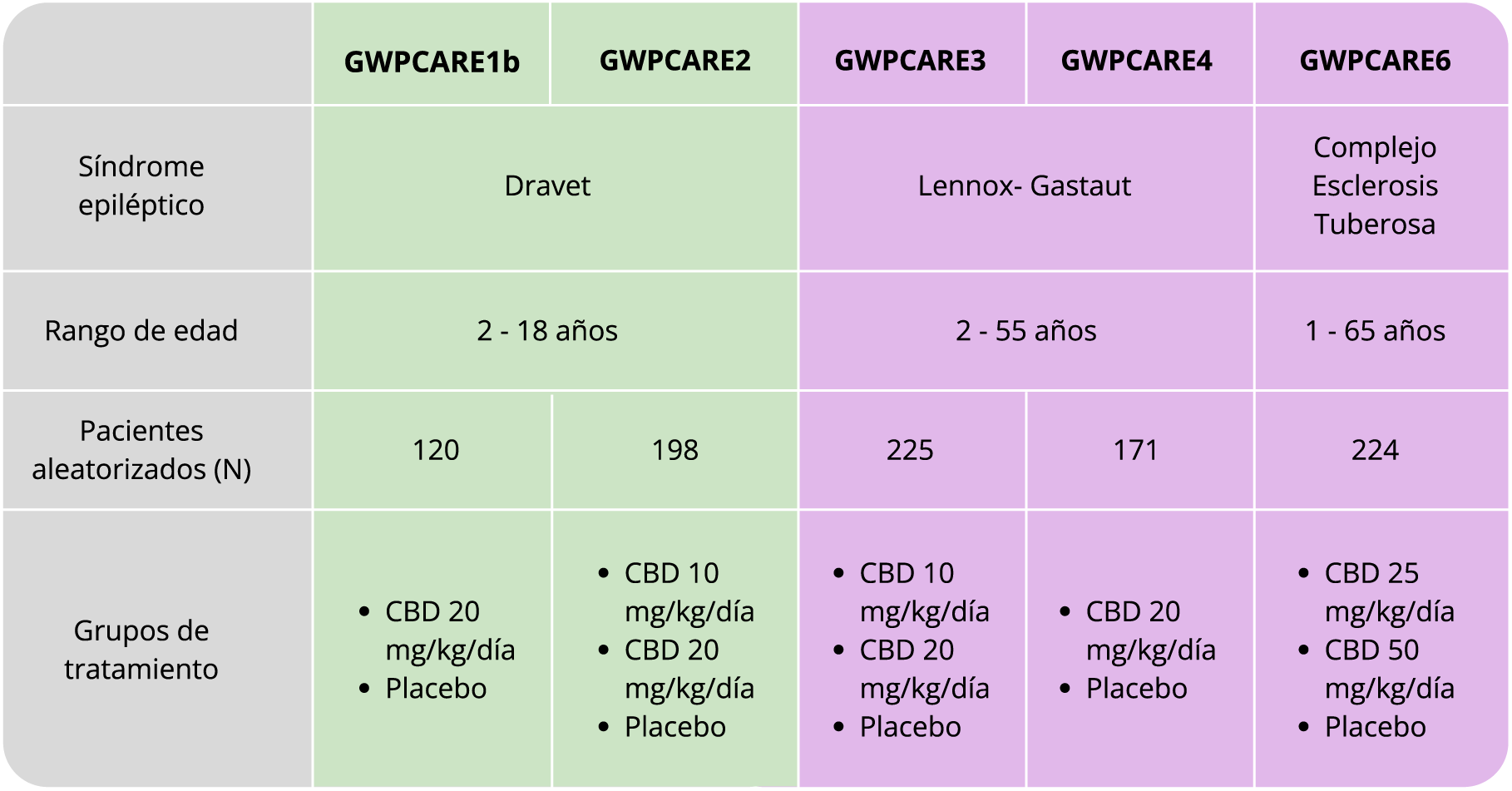
- dos estudios en SD → GWPCARE1b y GWPCARE2
- dos estudios en SLG → GWPCARE3 y GWPCARE4
- un estudio en CET → GWPCARE6
Además, se dispone de los datos de un estudio de extensión abierto (GWPCARE5) y del Programa de uso compasivo (Expanded Access Program) en Estados Unidos (Villanueva 2021; Strzelczyk 2020; Strzelczyk 2021; Von Wrede
2021; Farrelly 2021; Golub 2021; Miller 2020).
Estudios clínicos pivotales
Los ensayos clínicos de fase 3, tuvieron en común las siguientes características:
- Población: niños > 1 año, adolescentes y adultos hasta 65 años, con SD, SLG o CET.
- En conjunto, se evaluaron los datos de > 900 pacientes.
- Diseño:

- Objetivos: Evaluación de eficacia y seguridad de Cannabidiol como adyuvante de FAE convencionales de base, en dosis estable.
- Eficacia primaria: Reducción porcentual en la frecuencia mensual de un tipo de crisis específicas para cada EED, comparando el período de tratamiento con el basal.
- Crisis convulsivas en el SD.
- Crisis de caída en el SLG.
- Reducción de las crisis convulsivas en el CET.
- Determinar la seguridad y tolerabilidad del fármaco.
- Eficacia primaria: Reducción porcentual en la frecuencia mensual de un tipo de crisis específicas para cada EED, comparando el período de tratamiento con el basal.
- Tratamiento: solución oral con 100 mg/mL de Cannabidiol (> 98% de CBD y < 0,15% de THC).
- Dosis inicial de 5 mg/kg/día, titulada hasta 10-20 mg/kg/día, dos veces por día para SD y SLG.
- Dosis de 25 mg/kg/día hasta 50mg/kg/día para CET.
- Dosis inicial de 5 mg/kg/día, titulada hasta 10-20 mg/kg/día, dos veces por día para SD y SLG.
- Tratamientos concomitantes: Clobazam, valproato, lamotrigina, levetiracetam, estiripentol, topiramato, rufinamida. También, dieta cetogénica y estimulación del nervio vago.
Resultados de eficacia
En los estudios con pacientes con SD:
- En conjunto, la adición de Cannabidiol mostró reducciones significativamente mayores en la frecuencia mediana de crisis convulsivas por mes (38-48%), en comparación con placebo (13-26%). La diferencia entre los grupos con
Cannabidiol o placebo alcanzó significación estadística.
- La tasa de respondedores (pacientes con reducción ≥ 50% de las crisis convulsivas) también fue significativamente mayor con Cannabidiol (Tabla 2).
- Los pacientes que recibieron Cannabidiol alcanzaron además diferencia significativa en la reducción del total de crisis de todos los tipos, comparados con el grupo placebo.
- Cabe destacar que el 5% de los pacientes tratados con Cannabidiol alcanzaron el 100% de reducción de las crisis convulsivas versus 0% con placebo.
- La eficacia de Cannabidiol fue mayor en el subgrupo que recibió clobazam en forma concomitante.
En los estudios con pacientes con SLG:
- En uso de Cannabidiol se asoció con mejoría estadísticamente significativa y clínicamente trascendente de la frecuencia mediana de crisis de caída por mes (37-44%) en comparación con placebo (17-21%), así como con tasa significativamente mayor de respondedores (Tabla 2).
- Además, en ambos estudios resultó significativa la reducción de crisis distintas a las de caída y crisis totales, entre los pacientes que recibieron Cannabidiol versus placebo.
- En el estudio GWPCARE3, los pacientes estaban severamente afectados al inicio: presentaban una mediana de 80 crisis de caída y 160 crisis en total, por mes. El odds ratio (OR) para reducción ≥ 75% en la frecuencia de crisis de caída frente a placebo fue 12,33 (p < 0,001) y 4,55 (p = 0,03) con Cannabidiol 20 mg/kg/día y 10 mg/kg/día, respectivamente.
- Sin significación estadística pero de relevancia clínica, algunos pacientes lograron hallarse libres de crisis de caída, y se observó un aumento en el número de días sin crisis de caída por mes.
Considerando el impacto de este tipo de epilepsias en la calidad de vida de los pacientes y sus familiares/cuidadores, se evaluó la escala Subject/Caregiver Global Impression of Change (S/CGIC) en la última visita de los estudios (Golub 2021) El porcentaje de pacientes o cuidadores que informaron mejoría en la escala S/CGIC fue mayor en los grupos con Cannabidiol que con placebo (Tabla 2) (Golub 2021; Strzelczyk 2020; Strzelczyk 2021).
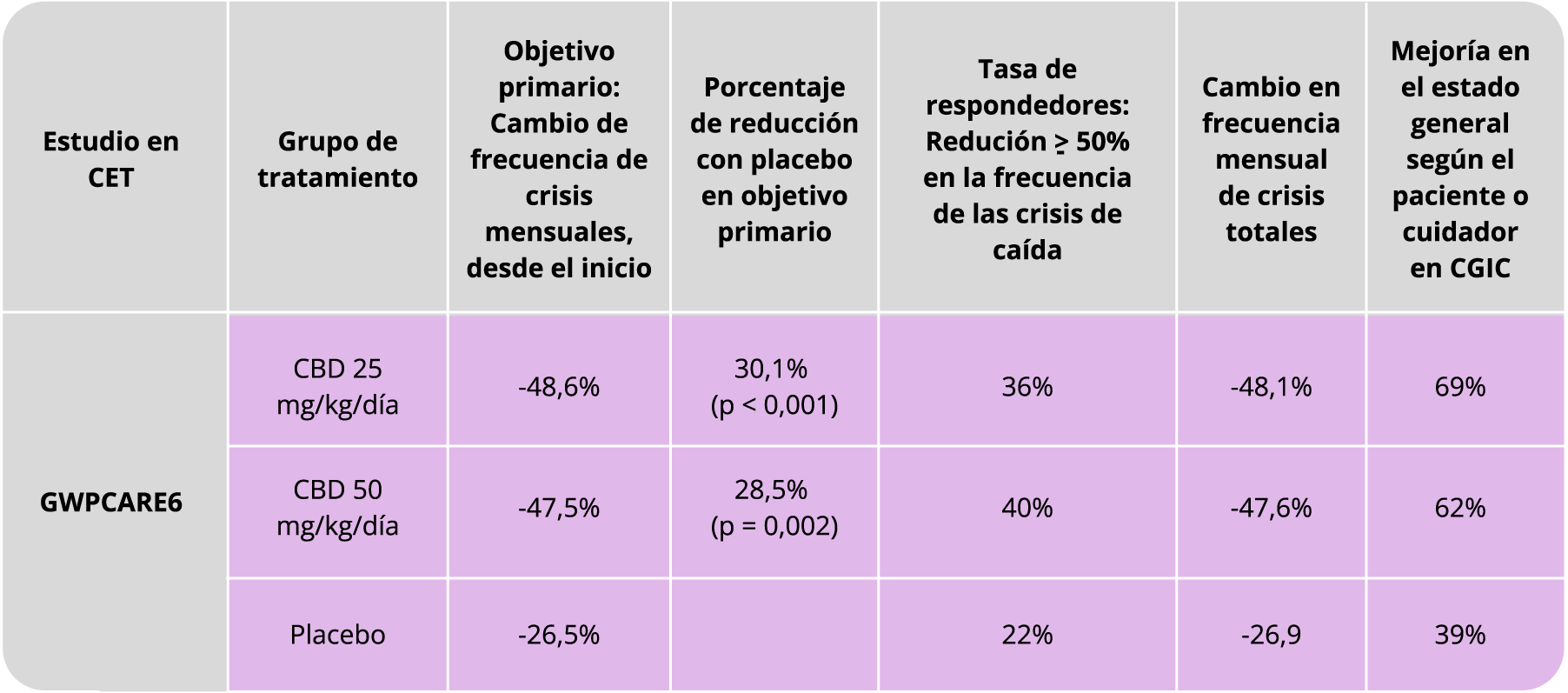
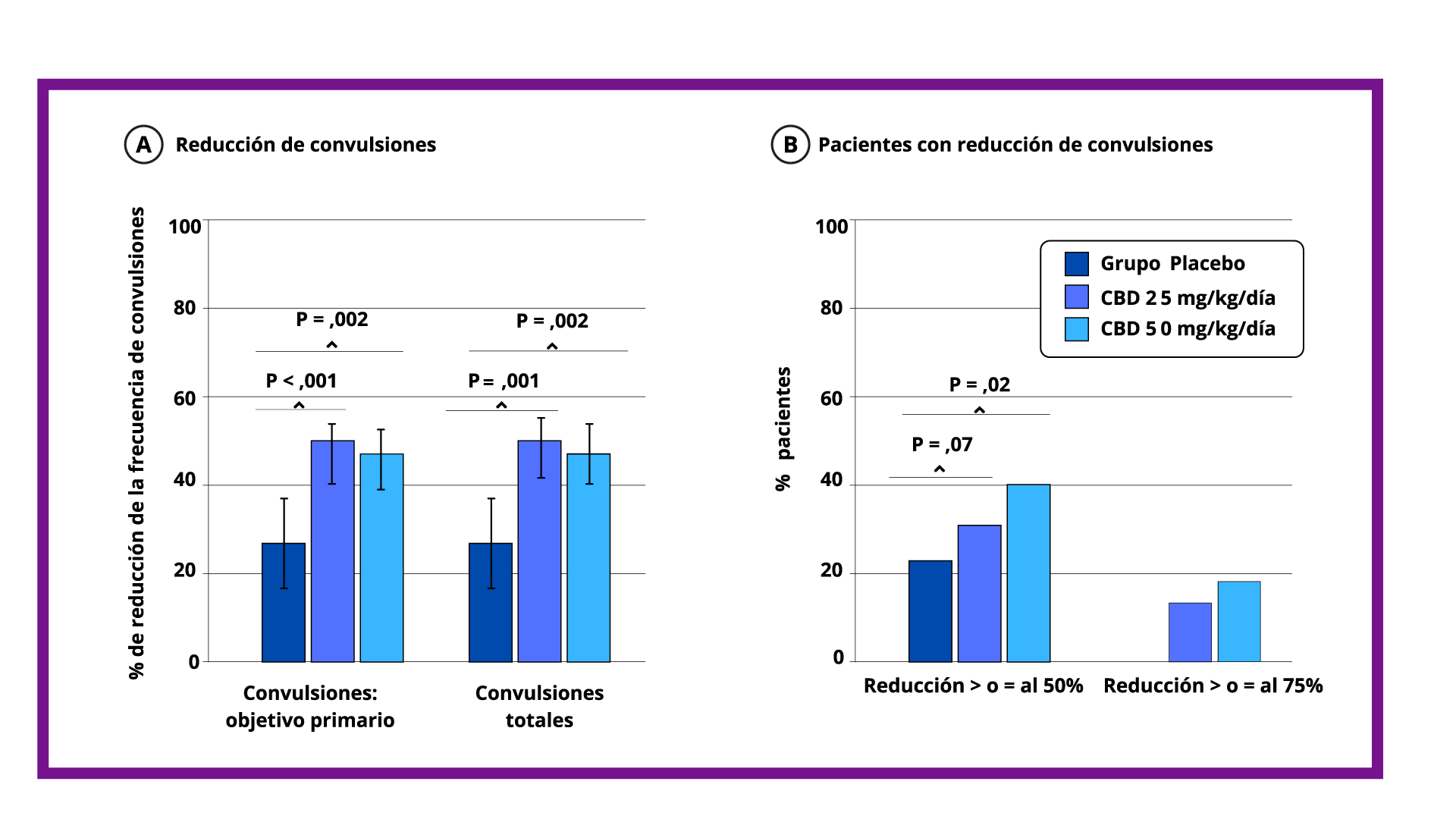
En los estudios con pacientes con CET (Thiele 2021, Thiele 2021, Wu 2022):
- La eficacia del Cannabidiol para el tratamiento de las convulsiones asociadas al CET se demostró en un ensayo clínico randomizado, doble ciego y controlado con placebo (GWPCARE6), que incluyó a 224 pacientes de 1 a 65 años.
- En el mismo se comparó Cannabidiol de 25mg/kg/día y 50mg/kg/día comparado con placebo. Los pacientes tenían diagnóstico de CET y convulsiones inadecuadamente controladas con al menos un FAE concomitante, con o sin estimulación del nervio vago o dieta cetogénica.
- En este estudio, se observó una reducción porcentual en el tipo de convulsiones del 47,5% para el grupo de 25 mg/kg/día, 48,6% para el grupo de CBD 50 mg/kg/día y 26,5% para el grupo placebo.
- Cannabidiol demostró una reducción significativa de las convulsiones asociadas al CET en comparación con el placebo en el día 6, con una dosis titulada de 15 mg/kg/día, y se volvió significativa (p < 0.049) para el día 10. También se observó una separación en la tasa de respuesta del ≥50% entre el placebo y el CBD para el día 10.

En una reciente publicación, los resultados de los estudios GWPCARE 3 y 4 fueron comparados con los obtenidos históricamente con FAE convencionales (Strzelcyk 2021), y se presentan en la Figura 3.

Resultados de seguridad
- En general, la solución oral de Cannabidiol fue bien tolerada (Von Wrede 2021; Villanueva 2021; Golub 2021; Strzelczyk 2020; Strzelczyk 2021 Thiele 2021).
- Los eventos adversos (EA) fueron más frecuentes en los pacientes que recibieron Cannabidiol (84-93%), pero también fueron frecuentes con placebo (69-89%).
- La mayoría de los EA fueron de intensidad leve o moderada, y transitorios.
- Los EA más frecuentes (> 10% de los pacientes) incluyeron:
- Somnolencia
- Disminución del apetito
- Gastrointestinales
- Diarrea
- Vómitos
- Pirexia
- Fatiga
- La somnolencia y la sedación fueron más frecuentes con el uso concomitante de clobazam. Cannabidiol aumentó la concentración plasmática de clobazam 3-4 veces.
- La elevación de las transaminasas fue más frecuente en los pacientes que recibían valproato concomitantemente (17%) o valproato y clobazam (23%), y mostró dependencia con la dosis de Cannabidiol.
- La causa más frecuente de discontinuación del tratamiento fue el aumento de las enzimas hepáticas.
Estudio de extensión con tratamiento abierto
Al término del tratamiento en los estudios de fase 3, un total de 264 pacientes con SD y 366 pacientes con SLG continuaron en un Estudio de extensión abierto (GWPCARE5) para evaluar la eficacia y la tolerabilidad de
Cannabidiol a largo plazo. (Villanueva 2021; Golub 2021; Von Wrede 2021)
En conjunto, los hallazgos de este estudio confirman que Cannabidiol posee un perfil de seguridad aceptable a largo plazo y que permitió alcanzar reducciones clínicamente relevantes en la frecuencia de las crisis, que se mantienen en el tiempo.
En un análisis interino luego de 48 semanas, los pacientes con SLG (dosis promedio de 23 mg/kg/día de Cannabidiol) habían reducido de forma sostenida las crisis de 47% a 57%. Similarmente, a las 48 semanas de seguimiento, los
pacientes con SD (dosis promedio de 21 mg/kg/día de Cannabidiol) redujeron el total de crisis de 39% a 51%. A las 48 semanas, el 85% de los pacientes y/o sus cuidadores informaron mejoría del estado general.
Los EA fueron similares a los descriptos en los estudios de fase 3, de intensidad leve o moderada, y resultando en discontinuación del tratamiento en menos del 10% de los pacientes.
En un estudio de extensión abierta sobre CET (GWPCARE6) se evaluó en las primeras 12 semanas, que el tratamiento con CBD redujo la frecuencia de convulsiones asociadas al CET en un 54%. Esta reducción se mantuvo en las ventanas de tratamiento hasta la semana 48, con variaciones del 54% al 68%. Los pacientes con dosis ≤25 mg/kg/día tuvieron reducciones del 52% al 73%, y aquellos con dosis >25 mg/kg/día mostraron reducciones del 49% al 61% hasta las 48 semanas. Más del 50% de los pacientes experimentaron una reducción del ≥50% en la frecuencia de convulsiones, y más del 25% tuvieron una reducción del ≥75%. A las 26 semanas, el 87% de los pacientes reportaron mejoras en su condición, y el 80% de los médicos notaron mejoras en la escala PGIC.
Evidencia de eficacia en otros tipos de epilepsias
En una revisión sistemática sobre el uso de una formulación oral con CBD de calidad farmacéutica, se observó respuesta al tratamiento en otras encefalopatías epilépticas: trastorno por deficiencia CDKL5, síndrome de Aicardi, encefalopatía Dup15q, síndromes de Doose o SYNGAP1, con reducción del 50-100% en la frecuencia mediana de las crisis. (Lattanzi S 2021)
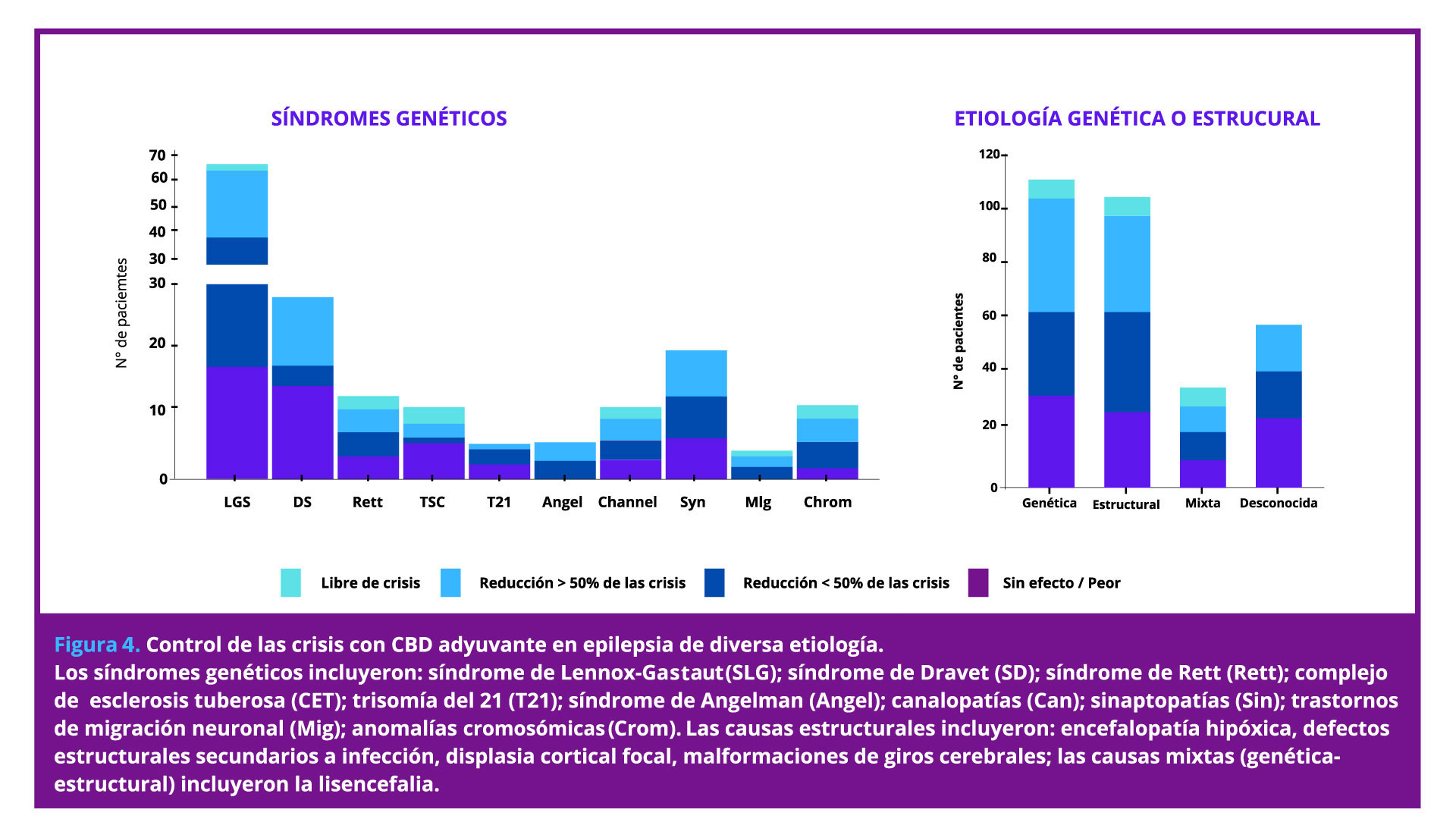
En un estudio reciente multicéntrico, retrospectivo, con 311 pacientes (edad: 0-72 años), el agregado de CBD fue altamente eficaz para controlar las crisis asociadas con epilepsia farmacorresistente de diversas etiologías, tanto genéticas como estructurales (Figura 4): (Kühne F,2023)
- La eficacia del CBD fue similar entre los individuos independientemente del tipo de epilepsia, durante una mediana de seguimiento de 16 meses.
- Los tipos de crisis incluyeron de inicio focal o generalizadas, motoras o no motoras.
- El CBD tuvo efectos positivos adicionales, tales como mejoría del estado de ánimo, del sueño nocturno y de la concentración.
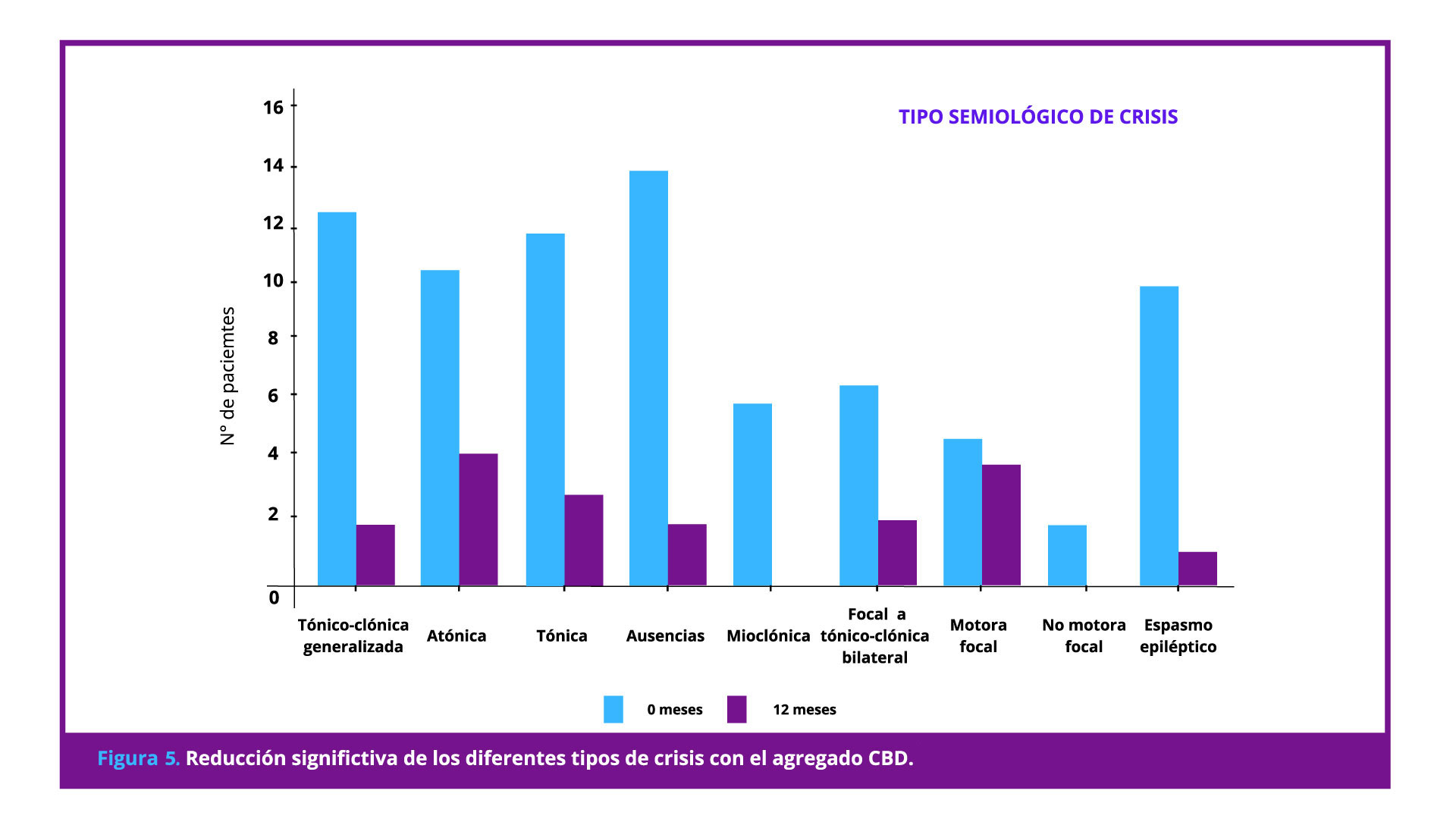
En otro estudio realizado en Latinoamérica se confirmó la eficacia del tratamiento con CBD en niños, adolescentes y adultos con crisis refractarias de etiología variada, tratados durante al menos un año. El diagnóstico de los pacientes incluyó: epilepsia focal sintomática, epilepsia mioclónica familiar, epilepsia parcial continua, síndrome de Lennox-Gastaut, síndrome de West, síndrome de Dravet, síndrome de Doose y síndrome de Ohtahara: (Pesántez Ríos G, 2022)
- La terapia adyuvante con CBD mostró un amplio espectro de acción sobre diferentes tipos de crisis (Figura 5).
- El agregado de CBD se asoció con reducción significativa de la frecuencia, la duración y la intensidad de las crisis.
En un estudio clínico abierto se ha evaluado el CBD en situaciones de urgencia, el CBD ha sido útil en niños con síndrome epiléptico relacionado con infección febril (FIRES, en inglés) con crisis altamente refractarias y casos individuales de status epiléptico súper refractario. (Lattanzi S 2021, Gofshteyn JS,2017)
Uso compasivo y práctica clínica
En 2014, la FDA de Estados Unidos autorizó un programa de uso compasivo para facilitar el acceso al Cannabidiol previo a su aprobación. Recientemente se informaron los datos de eficacia y seguridad a largo plazo de niños y
adultos con SLG o SD incluidos en dicho programa, que refleja las condiciones de la práctica clínica (Villanueva 2021; Golub 2021).
Los datos de seguimiento a más largo plazo (hasta 96 semanas) indicaron que añadir Cannabidiol a la terapéutica redujo las crisis mensuales en un 50% y el total de crisis en un 44%. A las 12 semanas, el porcentaje de pacientes
con disminución ≥ 50%, ≥ 75% y ≥ 100% de las crisis motoras fue 53%, 23% y 6%; la correspondiente reducción de las crisis totales fue 46%, 26% y 5%. La somnolencia y la diarrea fueron los EA más frecuentes.
Los datos confirman que Cannabidiol tiene un perfil de seguridad aceptable y eficacia sostenida durante el tratamiento a largo plazo de los pacientes con epilepsia resistente.
Características del la especialidad medicinal Kanbis®
Introducción
El principio activo de Kanbis® es Cannabidiol (CBD), un fitocannabinoide obtenido naturalmente de la planta Cannabis sativa L.
La formulación en solución oral contiene 100 mg de Cannabidiol cada 1 mililitro.
Kanbis® está indicado en el marco del tratamiento de convulsiones asociadas con el síndrome de Lennox-Gastaut o el síndrome de Dravet, en pacientes desde los 2 años de edad.
Estructura
Nombre químico del Cannabidiol: 2 – [(1R, 6R) -3-metil-6-prop-1-en-2-ylciclohex-2 -en-1-il]-5-pentilbenceno-1,3-diol.
Fórmula empírica: C21H30O2.
Peso molecular: 314,46.

Mecanismo de acción
- El mecanismo exacto que media las acciones anticonvulsivantes del Cannabidiol en los seres humanos permanece desconocido.
- El efecto anticonvulsivante del Cannabidiol no es mediado por los receptores cannabinoides.
- Cannabidiol reduce la hiperexcitabilidad neuronal a través de la modulación del calcio intracelular por el receptor GPR55 y TRPV1.
- Además, inhibe la recaptación celular de adenosina por el transportador equilibrador de nucleósidos 1 (ENT-1).


Farmacocinética
Absorción
Cannabidiol aparece de forma rápida en el plasma con un tiempo de concentración plasmática máxima de 2,5-5 horas en estado estacionario. Las concentraciones plasmáticas en estado estacionario
se alcanzan en 2 a 4 días con una dosificación diaria, dos veces al día, basado en las concentraciones predosificación. Alcanzar una concentración estable se relaciona con el perfil de eliminación multifásica del medicamento,
dado que la eliminación terminal solo representa una pequeña fracción de su depuración.
Efecto de la comida
La administración conjunta de Cannabidiol con una comida rica en grasas/hipercalórica aumentó cinco veces la concentración máxima, cuatro veces el área bajo la curva (ABC) de concentración-tiempo, y redujo la variabilidad total
de la exposición en comparación con el estado en ayunas, en voluntarios sanos. Para reducir la variabilidad de la biodisponibilidad de Cannabidiol en un paciente, deberá estandarizarse la administración de Cannabidiol en relación con la ingesta de alimentos,
incluida la dieta cetogénica (alta en contenido graso).
Distribución
El volumen aparente de distribución en voluntarios sanos fue de 20,963 L a 42,849 L, y superior al nivel total de agua corporal, lo que sugiere una amplia distribución de Cannabidiol. La unión a proteínas plasmáticas del Cannabidiol y sus metabolitos fue > 94% in vitro, con preferencia para la unión de albúmina de suero humano.
Biotransformación y eliminación
La vida media de Cannabidiol en plasma fue de entre 56 y 61 horas tras la administración dos veces al día durante 7 días, en voluntarios sanos. La concentración máxima (Cmáx) y el área bajo la curva (ABC) de Cannabidiol están
en proporción a la dosis en el rango terapéutico. Luego de una única dosis, la exposición en el rango de 750-6000 mg incrementa en menor medida que en proporción a la dosis, indicando que la absorción de Cannabidiol puede
ser saturable.
Metabolismo
Cannabidiol se metaboliza extensamente en el hígado mediante las enzimas CYP450 y las enzimas UGT. Las principales isoformas de CYP450 responsables del metabolismo en fase 1
de Cannabidiol son CYP2C19 y CYP3A4. Las isoformas de UGT responsables de la conjugación en fase 2 de Cannabidiol son UGT1A7, UGT1A9 y UGT2B.
En los estudios con sujetos sanos no se produjeron diferencias notables en cuanto a la exposición plasmática al Cannabidiol en metabolizadores CYP2C19 intermedios y ultrarrápidos, en comparación con metabolizadores rápidos.
Los metabolitos en fase 1 identificados en los ensayos in vitro estándares fueron 7-COOH-CBD, 7-OH-CBD y 6-OH-CBD (un metabolito menor en circulación). Luego de múltiples dosis de Cannabidiol, el metabolito 7-OH-CBD
(activo en el modelo preclínico de convulsiones) circula en plasma humano en concentraciones más bajas que la droga madre Cannabidiol (~ 40% de la exposición al CBD) según el ABC.
Eliminación
La depuración del Cannabidiol del plasma luego de una dosis única de 1.500 mg de Cannabidiol (1,1 veces la dosis diaria máxima recomendada) se establece en 1.111 L/h. Cannabidiol es principalmente eliminado en el hígado y el intestino y excretado por heces, siendo la depuración renal una vía menor. Cannabidiol no interactúa con los principales transportadores renales y hepáticos de forma que puedan resultar interacciones farmacológicas relevantes.
Poblaciones especiales
La edad, el peso, el sexo o la raza no produjeron efectos clínicamente relevantes en la exposición al fármaco. La farmacocinética de Cannabidiol no ha sido estudiada en personas con más de 65 años o menores de 1 año.
En pacientes con insuficiencia renal leve, moderada o severa, la administración de una dosis única de 200 mg de Cannabidiol no tuvo efecto sobre la Cmax ni el ABC del fármaco, en comparación con pacientes con función renal normal. No se han evaluado pacientes con enfermedad renal terminal.
En personas con insuficiencia hepática leve, la administración de una dosis única de 200 mg de Cannabidiol no afectó la exposición al fármaco o sus metabolitos. En insuficiencia hepática moderada o grave, se observaron concentraciones plasmáticas de Cannabidiol (ABC 2,5-5,2 veces más alta), en relación con individuos non función hepática normal. Se recomienda emplear una dosis inicial más baja en pacientes con insuficiencia hepática moderada o grave.
Posología y administración
El tratamiento con Kanbis® debe ser iniciado y controlado por especialistas con experiencia en epilepsia.
Antes de iniciar la administración de Kanbis®, solicitar niveles séricos de transaminasas (ALT y AST) y bilirrubina total a todos los pacientes.
Kanbis® debe ser administrado por vía oral. Se debe administrar de forma constante con o sin alimentos, incluida la dieta cetogénica, debido al efecto de los alimentos sobre los niveles de CBD.
- Dosis inicial recomendada: 2,5 mg/kg, dos veces por día (5 mg/kg/día), durante una semana.
- Dosis de mantenimiento: 5 mg/kg, dos veces por día (10 mg/kg/día) para SD y SLG. 12.5 mg/kg, dos veces por día (25mg/kg/día) para pacientes con CET.
- Dosis máxima recomendada: 10 mg/kg, dos veces por día (20 mg/kg/día) para pacientes con SD y SLG y 12,5mg/kg dos veces por día (25mg/kg/día) para pacientes con CET. Alcanzada con incremento semanal de 2,5 mg/kg, dos veces por día (5 mg/kg/día), siempre según balance riesgo-beneficio.
- Olvido de dosis: no deben compensarse las dosis olvidadas. Se debe retomar la administración según el programa de tratamiento actual. En caso de olvido de la dosis de más de siete días, deberá volver a ajustarse el tratamiento en función de la dosis terapéutica.
- Discontinuación: de ser necesario, la dosis de Kanbis® debe reducirse gradualmente. Al igual que con todos los fármacos antiepilépticos (FAE), se debe evitar la interrupción
abrupta cuando sea posible, para minimizar el riesgo de aumento de la frecuencia de crisis y de estado epiléptico. En los ensayos clínicos, la interrupción del tratamiento con Cannabidiol se consiguió reduciendo la
dosis en aproximadamente 10% por día, durante 10 días. En función de las indicaciones médicas, puede requerirse la disminución de dosis más rápida o más lenta, a criterio del médico prescriptor.
- Pacientes con insuficiencia renal: no se requiere ajuste de dosis de Cannabidiol en insuficiencia renal leve, moderada ni grave. No hay datos respecto a los pacientes con insuficiencia renal terminal. Se desconoce
si Cannabidiol es dializable.
- Pacientes con insuficiencia hepática: no se requiere ajustar la dosis de Cannabidiol en insuficiencia hepática leve (Child-Pugh A). Se recomienda ajustar la dosis en caso de insuficiencia hepática moderada (Child-Pugh B) o grave (Child-Pugh C). Puede ser necesario el incremento de dosis más lento en pacientes con insuficiencia hepática moderada o grave que en pacientes sin insuficiencia hepática. El ajuste
posológico debe realizarse según la Tabla a continuación:

Contraindicaciones
Kanbis® está contraindicado en pacientes con antecedentes de hipersensibilidad a Cannabidiol o a alguno de los componentes incluidos en su formulación.
Tampoco deben recibirlo los pacientes con elevación de las transaminasas mayor de 3 veces el límite superior de normalidad (LSN) y con aumento de la bilirrubina mayor de 2 veces el LSN.
Interacciones medicamentosas
Para interpretar las interacciones farmacológicas del Cannabidiol y su principal metabolito (7-OH-CBD), se determinaron in vitro sus efectos sobre los diferentes sistemas
de metabolización.

Tratamiento con FAE concomitantes
Las características farmacocinéticas de Cannabidiol son complejas y podrían provocar interacciones con los FAE concomitantes del paciente.
Las interacciones con FAE se evaluaron in vivo, en voluntarios sanos y en pacientes con síndrome de Lennox-Gastaut de un estudio de farmacocinética. Se describen las interacciones potenciales luego de dosis de 750
mg de Cannabidiol, dos veces por día.

2 El uso concomitante de Cannabidiol y valproato incrementa la incidencia de aumento de transaminasas.
3 Se desconoce la relevancia clínica de la interacción; sin embargo, se sugiere monitorear de cerca a estos pacientes por posibles reacciones adversas.
Fenitoína: La exposición a fenitoína podría aumentar cuando se administra de forma conjunta con Cannabidiol, ya que la fenitoína es metabolizada en gran medida mediante CYP2C9, que es inhibido por el Cannabidiol
in vitro. No se ha realizado ningún estudio clínico en el que se investigue de manera formal esta interacción. La fenitoína cuenta con un índice terapéutico muy estrecho, por lo que la combinación de Cannabidiol
con fenitoína debe iniciarse con cautela y, si surgen problemas de tolerabilidad, deberá considerarse realizar una reducción de la dosis de fenitoína.
Lamotrigina: Lamotrigina es un sustrato de enzimas UGT, incluida UGT2B7, que es inhibida por Cannabidiol in vitro. No se ha realizado ningún estudio clínico en el que se investigue de manera formal
esta interacción. Los niveles de lamotrigina pueden elevarse cuando se administra de manera conjunta con Cannabidiol.
Depresores del SNC y alcohol: El uso concomitante de Cannabidiol con otros depresores del SNC puede aumentar el riesgo de sedación y somnolencia.

Perspectivas a futuro
El potencial terapéutico del Cannabidiol se relaciona con sus múltiples mecanismos de acción. Su amplio rango de actividades farmacológicas sustenta los efectos sobre el estado de ánimo, la memoria, el dolor, el metabolismo, entre otros.
Se dispone de evidencia que sugiere su potencial utilidad en otros tipos de epilepsia, enfermedades neurodegenerativas, abuso y dependencia de sustancias, esquizofrenia, fobia social, estrés postraumático, depresión, trastorno bipolar, trastornos del sueño y otras condiciones (Golub 2021). Además de la neurología y la psiquiatría, otras áreas donde se realizan estudios sobre los efectos de los cannabinoides sintéticos y semisintéticos son la gastroenterología y la inmunología (Golub 2021).
La eficacia y la seguridad de Cannabidiol como adyuvante de los FAE se explora en diferentes formas de epilepsia resistente, incluyendo los espasmos infantiles (síndrome de West), la enfermedad de Rett y el
complejo de esclerosis tuberosa, y en otros tipos de crisis resistentes no asociadas con EED, tanto en niños como en adultos (Golub 2021; Strzelczyk, 2020; Strzelczyk, 2021; Farrelly 2021; Von Wrede 2021). Además, el programa
de uso compasivo en Estados Unidos, aporta evidencia creciente desde 2014 sobre la eficacia y la seguridad del Cannabidiol a largo plazo en pacientes con epilepsia resistente, más allá de los síndromes de Dravet y Lennox-Gastaut
(Golub 2021).
En 2020, el Cannabidiol fue aprobado por la FDA para el tratamiento del complejo de esclerosis tuberosa en base a los datos de un estudio aleatorizado y controlado con placebo, con 224 pacientes (GWPCARE6). Se administró Cannabidiol
de calidad farmacéutica en dosis de 25 o 50 mg/kg/día. La mediana de reducción de la frecuencia de las crisis epilépticas fue significativamente mayor en los grupos con Cannabidiol (43% y 37%) que con placebo (20%) (von
Wrede 2021; Raucci 2020).
En los síndromes que cursan con retraso psicomotriz, además de las crisis epilépticas o presentar rasgos autistas, el tratamiento con cannabinoides como el Cannabidiol puede mejorar la esfera cognitiva y las alteraciones motoras. Hay evidencia en pacientes tratados con Cannabidiol de cambios cognitivos, con adquisición de nuevas habilidades, mejoría de la interacción con el entorno, recuperación de la marcha autónoma, mejor respuesta a estímulos verbales y mejora de la comprensión.
El Cannabidiol podría mitigar el daño cerebral asociado con la neurodegeneración y la inflamación, y tener efecto sobre la plasticidad sináptica y la neurogénesis. Se demostró que estimula la neurogénesis en el hipocampo en roedores y que constituye un potente antioxidante (Farrelly 2021; Golub 2021; Basavarajappa 2017; Almeida 2020). Junto con ello, el efecto modulador de los endocannabinoides sobre la neurotransmisión glutamatérgica y GABAérgica, convierte a estos compuestos en blancos de interés para el tratamiento de enfermedades autoinmunitarias, el accidente cerebrovascular y enfermedades neurodegenerativas graves como: enfermedad de Alzheimer, enfermedad de Parkinson, esclerosis lateral amiotrófica, enfermedad de Huntington y otras (Basavarajappa 2017; Golup 2021; Silvestro 2019).
Las estrategias terapéuticas para las enfermedades neurodegenerativas no solo consideran sus propiedades neuroprotectoras sino la posibilidad de aliviar síntomas (Basavarajappa 2017). En pacientes con enfermedad de Parkinson, el Cannabidiol atenuó los síntomas motores y mejoró la calidad de vida (Golub 2021).
En el área de la psiquiatría, la administración de Cannabidiol se asoció con disminución de la ansiedad al hablar en público en individuos con ansiedad social. Se ha evaluado en estudios de pequeño tamaño en pacientes con ansiedad
asociada al abuso de sustancias, con resultados alentadores: atenúa la alteración en los procesos emocionales y de recompensa posteriores a la administración de THC (Almeida 2020). En pacientes con esquizofrenia, el agregado
de Cannabidiol a la medicación antipsicótica redujo el puntaje de síntomas psicóticos positivos en las evaluaciones. Al carecer de los efectos adversos psicoactivos del Δ9-THC, e incluso atenuar sus efectos deletéreos sobre
las funciones cognitivas, el Cannabidiol plantea un interesante potencial terapéutico, con balance riesgo-beneficio favorable (García-Gutiérrez 2020; Golub 2021).
Referencias
Almeida DL, Devi LA. (2020) Diversity of molecular targets and signalling pathways for CBD. Pharmacol Res Perspect.,00:e00682. https://doi.org/10.1002/prp2.682.
ANMAT. (junio 21, 2017) Cannabinoides y Epilepsia. Informe ultrarrápido de evaluación de tecnología sanitaria. Buenos Aires: Administración Nacional de Medicamentos, Alimentos y Tecnología Médica, Ministerio de Salud, República
Argentina. En: http://www.anmat.gov.ar/ets/cannabinoides_y_epilepsia.pdf.
Aronica E, Specchio N, Luinenburg MJ, Curatolo P. Epileptogenesis in tuberous sclerosis complex-related developmental and epileptic encephalopathy. Brain. 2023 Jul 3;146(7):2694-2710. doi: 10.1093/brain/awad048. PMID: 36806388; PMCID: PMC10316778.
Basavarajappa BS, Shivakumar M, Joshi V, Subbanna S. (2017) Endocannabinoid system in neurodegenerative disorders. J Neurochem.,142, 624-48.
Cather JC, Cather JC. (2020) Cannabidiol primer for healthcare professionals. Proc Bayl Univ Med Cent.,33, 376-9.
United Nations Commission on Narcotic Drugs. Vienna, (2 December 2020) CND votes on recommendations for cannabis and cannabis-related substances. Press release. En: https://www.unodc.org/documents/commissions/CND/CND_Sessions/CND_63Reconvened/Press_statement_CND_2_December.pdf.
Chu-Shore CJ, Major P, Camposano S, et al. The natural history of epilepsy in tuberous sclerosis complex. Epilepsia 2010; 51:1236.
Crocq M-A. (2020) History of cannabis and the endocannabinoid system. Dialogues Clin Neurosci.,22(3), 223 228. doi:10.31887/DCNS.2020.22.3/mcrocq.
Curatolo P, Moavero R, de Vries PJ. Neurological and neuropsychiatric aspects of tuberous sclerosis complex. Lancet Neurol. 2015 Jul;14(7):733-45. doi: 10.1016/S1474-4422(15)00069-1. PMID: 26067126.
Decreto Reglamentario 883/20. Programa Nacional para el Estudio y la Investigación del Uso Medicinal de la Planta de Cannabis, sus derivados y tratamientos no convencionales. Ley 27.350 – Su Reglamentación. Poder Ejecutivo
Nacional, República Argentina (noviembre 11, 2020). En: http://servicios.infoleg.gob.ar/infolegInternet/anexos/340000-344999/344131/norma.htm.
Farach LS, Richard MA, Lupo PJ, et al. Epilepsy Risk Prediction Model for Patients With Tuberous Sclerosis Complex. Pediatr Neurol 2020; 113:46.
Farrelly AM, Vlachou S, Grintzalis K. (2021) Efficacy of phytocannabinoids in epilepsy treatment: novel approaches and recent advances. Int J Environ Res Public Health, 18, 3993.
García-Gutiérrez MS, Navarrete F, Gasparyan A, Austrich-Olivares A, Sala F, Manzanares J. (2020) Cannabidiol: a potential new alternative for the treatment of anxiety, depression, and psychotic disorders. Biomolecules,
10(11), 1575.
Gofshteyn JS, Wilfong A, Devinsky O, et al. Cannabidiol as a potential treatment for febrile infection-related epilepsy syndrome (FIRES) in the acute and chronic phases. J Child Neurol. 2017; 32: 35-40.
Golub V, Reddy DS. (2021) Chapter 7. Cannabidiol therapy for refractory epilepsy and seizure disorders. En Murillo-Rodriguez E. et al. (Eds.), Cannabinoids and Neuropsychiatric Disorders, Advances in Experimental Medicine and Biology (Volume 1264, pp. 93-110). Springer Nature Switzerland.
Goodrick S. The road to Vogt's triad. Lancet Neurol 2015; 14:690.
Joinson C, O'Callaghan FJ, Osborne JP, et al. Learning disability and epilepsy in an epidemiological sample of individuals with tuberous sclerosis complex. Psychol Med 2003; 33:335.
Kanbis®. Información para prescribir. Laboratorio Elea Phoenix SA.
Kühne F, Becker L, Bast T, et al. Real-world data on cannabidiol treatment of various epilepsy subtypes: A retrospective, multicenter study. Epilepsia Open. 2023; Jan 24. doi: 10.1002/epi4.12699.
Lattanzi S, Trinka E, Striano P, et al. Highly purified Cannabidiol for epilepsy treatment: A systematic review of epileptic conditions beyond Dravet Syndrome and Lennox–Gastaut Syndrome. CNS Drugs. 2021; 35: 265-81.
Larsen C, Shahinas J. (2020) Dosage, efficacy and safety of cannabidiol administration in adults: a systematic review of human trials. J Clin Med Res., 12, 129-41.
Ley 27.350/17. Investigación Médica y Científica del Uso Medicinal de la Planta de Cannabis y sus derivados. Ministerio de Justicia y Derechos Humanos, República Argentina (abril 19, 2017). En: https://www.argentina.gob.ar/normativa/nacional/ley-27350-273801/texto.
Lyczkowski DA, Conant KD, Pulsifer MB, et al. Intrafamilial phenotypic variability in tuberous sclerosis complex. J Child Neurol 2007; 22:1348.
Miller I, Scheffer IE, Gunning B, et al. (2020) Dose-ranging effect adjunctive oral cannabidiol vs placebo on convulsive seizure frequency in Dravet syndrome. A randomized clinical trial. JAMA Neurol., 77, 613-21.
Northrup H, Wheless JW, Bertin TK, Lewis RA. Variability of expression in tuberous sclerosis. J Med Genet. 1993 Jan;30(1):41-3. doi: 10.1136/jmg.30.1.41. PMID: 8423606; PMCID: PMC1016232.
Pesántez Ríos G, Armijos Acurio L, Jimbo Sotomayor R, et al. A pilot study on the use of low doses of CBD to control seizures in rare and severe forms of drug-resistant epilepsy. Life. 2022; 12: 2065.
Osborne JP, Fryer A, Webb D. Epidemiology of tuberous sclerosis. Ann N Y Acad Sci. 1991;615:125-7. doi: 10.1111/j.1749-6632.1991.tb37754.x. PMID: 2039137.
Peron A, Au KS, Northrup H. Genetics, genomics, and genotype-phenotype correlations of TSC: Insights for clinical practice. Am J Med Genet C Semin Med Genet. 2018 Sep;178(3):281-290. doi: 10.1002/ajmg.c.31651. Epub 2018 Sep 26. PMID: 30255984.
Raucci U, Pietrafusa N, Paolino MC, et al. (2020) Cannabidiol treatment for refractory epilepsies in pediatrics. Front. Pharmacol., 11, 586110. doi: 10.3389/fphar.2020.586110.
Russo E. (s.f.) Historia del cannabis como medicamento. Uso terapéutico del cannabis y los cannabinoides. Grupo Ars XXI de Comunicación, S.L. En: http://www.biblioteca.cij.gob.mx/Archivos/Materiales_de_consulta/Drogas_de_Abuso/Articulos/Historia8.pdf.
Schwartz RA, Fernández G, Kotulska K, Jóźwiak S. Tuberous sclerosis complex: advances in diagnosis, genetics, and management. J Am Acad Dermatol 2007; 57:189.
Silva DG, Borelli Del Guerra F, de Oliveira Lelis M, Figueira Pinto L. (2020) Cannabidiol in the treatment of epilepsy: a focused review of evidence and gaps. Front Neurol., 11, 531939.
Silvestro S, Mammana S, Cavalli E, Bramanti P, Mazzon E. (2019) Use of cannabidiol in the treatment of epilepsy: efficacy and security in clinical trials. Molecules, 24, 1459.
Strzelczyk A, Schubert-Bast S. (2021) Expanding the treatment landscape for Lennox-Gastaut syndrome: current and future strategies. CNS Drugs, 35, 61-83.
Strzelczyk A, Schubert-Bast S. (2020) Therapeutic advances in Dravet syndrome: a targeted literature review. Expert Rev Neurother., 10, 1065-79.
Thiele EA, Bebin EM, Filloux F, Kwan P, Loftus R, Sahebkar F, Sparagana S, Wheless J. Long-term Cannabidiol treatment for seizures in patients with tuberous sclerosis complex: An open-label extension trial. Epilepsia. 2022 Feb;63(2):426-439. doi: 10.1111/epi.17150. Epub 2021 Dec 27. PMID: 34957550; PMCID: PMC9305454.
Thiele EA, Bebin EM, Bhathal H, Jansen FE, Kotulska K, Lawson JA, O'Callaghan FJ, Wong M, Sahebkar F, Checketts D, Knappertz V; GWPCARE6 Study Group. Add-on Cannabidiol Treatment for Drug-Resistant Seizures in Tuberous Sclerosis Complex: A Placebo-Controlled Randomized Clinical Trial. JAMA Neurol. 2021 Mar 1;78(3):285-292. doi: 10.1001/jamaneurol.2020.4607. PMID: 33346789; PMCID: PMC7754080.
VanDolah HJ, Bauer BA, Mauk KF. (2019) Clinician’s guide to cannabidiol and hemp oils. Mayo Clin Proc., 94, 1840-51.
Villanueva V, Carreño-Matínez M, Gil Nagel-Rein A, López-González FJ. (2021) Cannabidiol en los síndromes de Dravet y Lennox-Gastaut: un nuevo abordaje terapéutico. Rev Neurol.,71 (Supl.1):S1-S10.
Von Wrede R, Helmstaedter C, Surges R. (2021) Cannabidiol in the treatment of epilepsy. Clin Drug Invest., 41, 211-20.
Wu JY, Cock HR, Devinsky O, Joshi C, Miller I, Roberts CM, Sanchez-Carpintero R, Checketts D, Sahebkar F. Time to onset of Cannabidiol treatment effect and resolution of adverse events in tuberous sclerosis complex: Post hoc analysis of randomized controlled phase 3 trial GWPCARE6. Epilepsia. 2022 May;63(5):1189-1199. doi: 10.1111/epi.17199. Epub 2022 Mar 4. PMID: 35175622; PMCID: PMC9314914.
Yates JR, Maclean C, Higgins JN, et al. The Tuberous Sclerosis 2000 Study: presentation, initial assessments and implications for diagnosis and management. Arch Dis Child 2011; 96:1020.
Zaheer S, Kumar D, Khan MT, Giyanwani PR. (2018) Epilepsy and cannabis: a literature review. Cureus, 10(9): e3278.

